-
棕櫚酰化的“鐵幕”:ZDHHC8如何操控腫瘤鐵死亡?
發布時間: 2025-07-29 點擊次數: 10次研究背景
鐵死亡(Ferroptosis)是一種新發現的程序性細胞死亡形式,以脂質過氧化為特征,與多種病理生理過程密切相關,包括衰老、神經退行性疾病、缺血再灌注損傷、病毒感染以及癌癥進展等,但其翻譯后調控機制尚未wan全明確。谷胱甘tai過氧化物酶4(GPX4)是一種關鍵酶,能夠緩解脂質過氧化,而S-棕櫚酰化是一種可調節蛋白質穩定性、亞細胞定位和活性的脂質-蛋白質修飾。本研究旨在探索S-棕櫚酰化在鐵死亡中的作用,特別是其對GPX4的調控,以及這種調控對腫瘤免疫治療的影響。
研究結果
1. 阻斷棕櫚酰化增加腫瘤細胞鐵死亡
研究人員通過篩選1000種小分子化合物,發現棕櫚酰化抑制劑2-溴棕櫚酸(2-BP)能夠顯著增強多種腫瘤細胞(包括人類成纖維肉瘤細胞、惡性黑色素瘤細胞和結直腸癌細胞)對鐵死亡的敏感性。實驗結果顯示,2-BP不僅增加了脂質過氧化水平,還特異性地促進了由GPX4抑制劑(如RSL3和ML162)以及SLC7A11抑制劑IKE誘導的鐵死亡。此外,2-BP在不同類型的癌細胞中均表現出對鐵死亡敏感性的增強作用,這表明阻斷棕櫚酰化是一種潛在的增強腫瘤細胞鐵死亡的策略。
2. GPX 4棕櫚酰化對鐵死亡抗性至關重要
研究團隊進一步探索了棕櫚酰化在調節鐵死亡中的主要靶點,發現GPX4能夠被棕櫚酰化,并且2-BP處理顯著降低了GPX4的棕櫚酰化水平。通過一系列GPX4突變體的構建和實驗,研究人員確定了Cys75是GPX4棕櫚酰化的關鍵位點。在GPX4基因敲除(KO)細胞中,C75S突變體的補回顯著增加了細胞對鐵死亡的敏感性,而野生型GPX4的補回則沒有這種效果。這表明GPX4是棕櫚酰化調節鐵死亡的主要靶點,其棕櫚酰化狀態對鐵死亡抗性起著決定性作用。

3. ZDHHC8介導GPX4棕櫚酰化
為了確定GPX4棕櫚酰化的S-酰基轉移酶,研究人員對ZDHHCs家族的所有成員進行了篩選,發現ZDHHC8對增加GPX4棕櫚酰化水平的影響最大。共免疫沉淀實驗表明,ZDHHC8能夠與GPX4相互作用,并且這種相互作用在鐵死亡誘導下會增強。通過分子對接分析,研究人員發現ZDHHC8的催化位點Cys134與GPX4的Cys75在空間上接近,這可能解釋了為什么Cys75是GPX4棕櫚酰化的關鍵位點。此外,ZDHHC8的催化活性對于調節GPX4棕櫚酰化至關重要,其C134S突變體失去了對GPX4的棕櫚酰化能力。
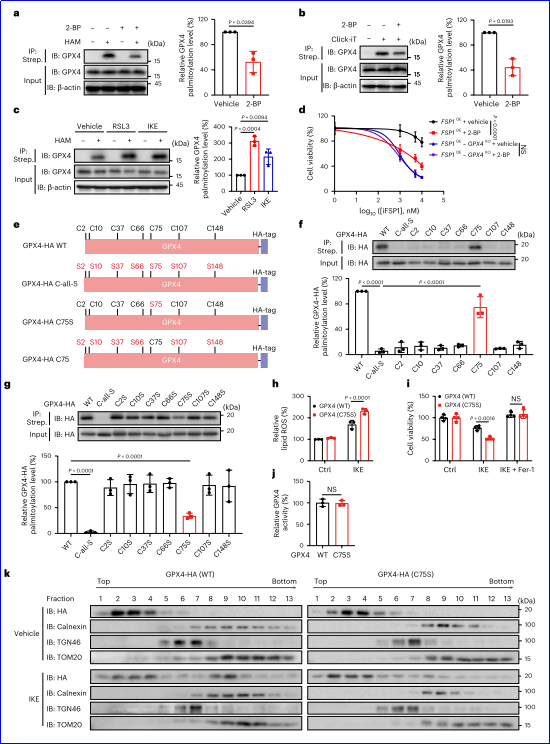
4. ZDHHC 8通過GPX 4確定鐵死亡敏感性
研究人員發現,ZDHHC8的缺失顯著增強了HT-1080細胞對RSL3誘導的細胞死亡和脂質過氧化的敏感性。這種現象在其他鐵死亡誘導劑(如ML162、IKE以及IFNγ聯合AA)下也有所體現。在結直腸癌患者來源的類器官中,ZDHHC8的敲低也顯著增強了對IFNγ聯合AA誘導的鐵死亡的敏感性。進一步的實驗表明,只有補回野生型ZDHHC8才能顯著恢復對鐵死亡的抵抗性,而其催化活性缺失的突變體C134S則沒有這種效果。此外,ZDHHC8對鐵死亡的調節作用并不依賴于SLC7A11,而是主要通過GPX4實現。

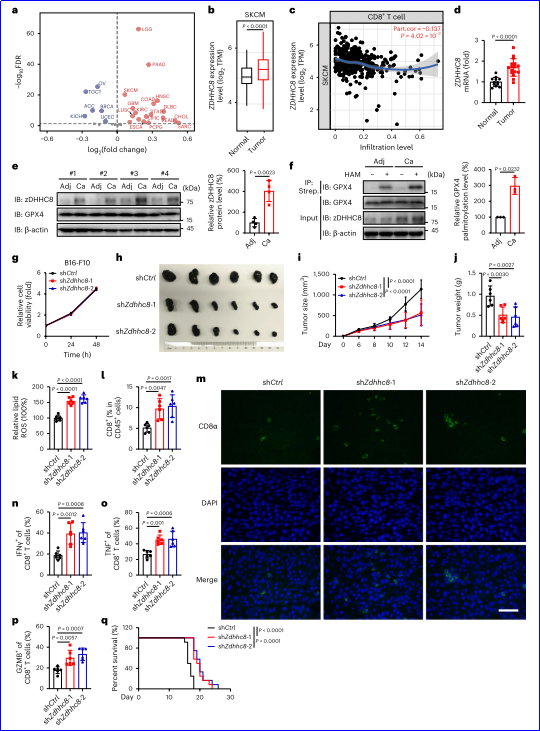
5. PF-670462抑制ZDHHC8介導的GPX 4棕櫚酰化
基于ZDHHC8的核心結構,研究人員通過虛擬篩選和實驗驗證,發現PF-670462是ZDHHC8的一個小分子抑制劑,能夠顯著增強多種腫瘤細胞對鐵死亡的敏感性。PF-670462與ZDHHC8的結合不依賴于其已知的靶點CK1δ/ε,而是通過直接與ZDHHC8結合并促進其溶酶體降解來降低GPX4的棕櫚酰化水平,進而增強腫瘤細胞對鐵死亡的敏感性。此外,PF-670462在體內應用時能夠有效增強CD8+細胞毒性T細胞的抗腫瘤功能,且與抗PD-1治療聯合使用時能夠進一步限制腫瘤生長,延長小鼠的生存期。

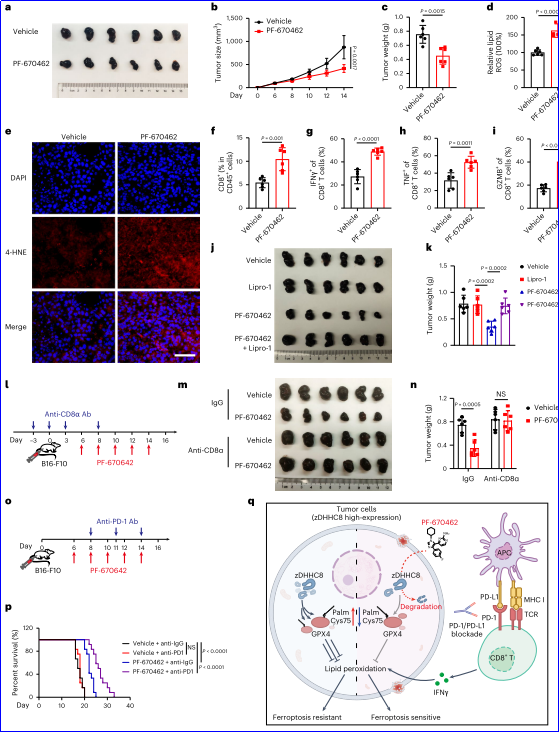
6. PF-670462增強體內抗腫瘤免疫應答
在體內實驗中,研究人員發現PF-670462能夠顯著抑制B16-F10腫瘤小鼠的腫瘤生長,并增強腫瘤細胞的脂質過氧化水平。此外,PF-670462處理的腫瘤組織中CD8+細胞毒性T細胞的浸潤顯著增加,且IFNγ+、TNF+和GZMB+CD8+細胞毒性T細胞的數量也顯著增多。這些結果表明,PF-670462通過增強腫瘤細胞對鐵死亡的敏感性,促進了免疫細胞的浸潤,從而抑制了腫瘤的生長和轉移。此外,PF-670462與抗PD-1治療聯合使用時,能夠進一步增強抗腫瘤效果,延長小鼠的生存期,這表明PF-670462是一種有潛力的腫瘤免疫治療藥物。
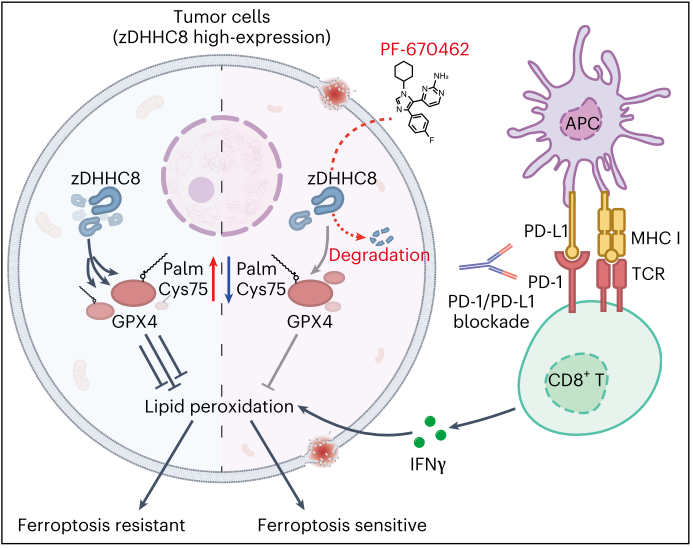
研究結論
本研究揭示了ZDHHC8介導的GPX4棕櫚酰化在調節鐵死亡中的關鍵作用,并發現PF-670462作為一種ZDHHC8的小分子抑制劑,能夠通過降低GPX4的棕櫚酰化水平來增強腫瘤細胞對鐵死亡的敏感性,進而促進免疫細胞的浸潤,抑制腫瘤生長和轉移。這些發現不僅為理解鐵死亡的調控機制提供了新的見解,還為開發新的腫瘤免疫治療策略提供了潛在的靶點和藥物候選物。
Zhou L, Lian G, Zhou T, Cai Z, Yang S, Li W, Cheng L, Ye Y, He M, Lu J, Deng Q, Huang B, Zhou X, Lu D, Zhi F, Cui J. Palmitoylation of GPX4 via the targetable ZDHHC8 determines ferroptosis sensitivity and antitumor immunity. Nat Cancer. 2025 May;6(5):768-785. doi: 10.1038/s43018-025-00937-y. Epub 2025 Mar 19. PMID: 40108413.
- 下一篇:曠場動物實驗的關鍵注意事項
- 上一篇:TIM3 乳腺癌細胞在微轉移爆發期介導免疫逃逸





